La mesure de l’oxygène dissous dans l’eau des systèmes aquaponiques domestiques, avec les outils du commerce, est soit très coûteuse, soit très imprécise. Il est toutefois possible d’auto construire un oxymètre pour moins de 50 €, avec des résultats assez précis, sous réserve d’un étalonnage méticuleux.
Les outils pour mesurer l’oxygène dissous dans l’eau
Les oxymètres à sonde optique sont de loin les plus simples à utiliser et les plus performants. Les sondes permettent des mesures sans consommation d’oxygène. Elles sont quasiment sans entretien et instantanément disponibles. Elles permettent également des mesures en continu, avec enregistrement des données. Mais on ne trouve pas de bonnes sondes étanches à moins de 1000 €. Ce qui est un frein en aquaponie domestique.
Les sondes polarographiques et galvaniques sont un peu moins coûteuses (500 à 1000 €) mais nécessitent un entretien fastidieux avec rajout d’électrolyte, remplacement de membrane fréquent et des conditions de mesure avec une eau en mouvement, car l’électrode consomme de l’oxygène pendant la mesure.
Les analyses chimiques sont très précises mais le protocole de mesure nécessite du matériel de laboratoire et une grande dextérité dans la mise en oeuvre. Elles ne permettent pas des mesures en continu. Réservées aux laboratoires.
L’analyse de l’oxygène dissous par colorimétrie à été très étudiée avant l’apparition des sondes. Le bulletin français de pisciculture publie en 1934, un article sur le titrage approximatif de l’oxygène dissous dans l’eau selon la méthode de B Hofer . Méthode que l’on retrouve aujourd’hui dans les tests gouttes. Ces tests (15 € pour une trentaine de mesures) sont d’un usage aisé. Mais les résultats sont très imprécis (+/- 2 mg O2/l), ce qui réduit leur intérêt pour analyser le fonctionnement d’un système aquaponique vis à vis de l’oxygène dissous. Cette approche colorimétrique a été améliorée avec le recours à un spectrophotomètre ou un photomètre et le choix de nouveaux réactifs. Pour un coût matériel de 300 à 800 € et une dépense en réactif par analyse autour de 2 à 3 €.
Un aquaponiste non professionnel délaisse la mesure de l’oxygène dissous, le plus souvent pour des raisons financières compte tenu du coût, ou par imprécision des solutions bon marché. Or cette information est un paramètre majeur lorsque l’on élève des salmonidés. Pour contourner la difficulté, il est possible de construire soi-même un oxymètre par colorimétrie pour moins de 50 €. Avec un smartphone et deux produits chimiques. Assez précis (+/- 0.5 mg/l, voire 0.3 mg/l avec plusieurs échantillons par analyse) , très facile d’emploi. Certes, c’est fastidieux à paramétrer, méticuleux à construire…mais c’est possible.
Le test de Wickler comme base de départ
Le test de Wickler est une méthode d’analyse chimique de l’oxygène dissous dans l’eau, très précise, qui sert notamment à mesurer la précision des sondes oxymétriques. Le protocole national donne le détail des étapes:
- On précipite de l’hydroxyde de manganèse(II) en ajoutant un excès d’hydroxyde de sodium à une solution de chlorure de manganèse(II) .
- L’oxygène renfermé dans l’eau et que nous voulons doser oxydera (lentement) en milieu basique une certaine quantité de cet hydroxyde de manganèse(II) en oxyde et hydroxyde mixte de manganèse(III): MnO(OH) ( s ).
- L’ajoute d’acide phosphorique dissout cette dernière substance en libérant l’ion manganèse(III)
- Si on a pris soin d’ajouter au préalable un excès d’iodure dans le milieu, celui-ci sera oxydé immédiatement par l’ion manganèse(III) en iode.
- L’iode pourra être dosé par une solution étalonnée de thiosulfate de sodium en présence d’amidon ( iodométrie )
- On recalculera à partir de la quantité d’iode ainsi déterminée la quantité de manganèse(III) mise en œuvre et finalement la quantité d’oxygène initialement dissoute.
Seuls, les deux premières étapes, sans ajout d’iode, sont retenues pour la mise en oeuvre de l’oxymètre par colorimétrie.
Obtenir un précipité de manganèse proportionnel à l’oxygène dissous présent dans l’échantillon.
- Acquérir du chlorure de manganèse tétrahydraté, MnCl2, 4H2O (Par exemple 250 g auprès de Laboratorium discounter pour 19 € avec le port).
- Acquérir 500 g d’hydroxyde de sodium ou soude caustique (NaOH) pour environ 6 €.
- Préparer un réactif R1 avec 250 g de chlorure de manganèse tétra hydraté dans 1 litre d’eau déminéralisée. (ou 25 g dans 100 ml). Produit toxique, donc gants, lunettes de protection et masque. A conserver en flacon étiqueté, à la température ambiante.
- Préparer un réactif R2 avec 320 g de soude caustique dans 1 litre d’eau (ou 32 g dans 100 ml). Produit toxique, donc gants, lunettes de protection et masque. Attention : refroidir la préparation pendant la dissolution avec un bain marie d’eau froide. A conserver en flacon étiqueté à température ambiante.
- Échantillonner l’eau à analyser dans un flacon de 15 à 25 ml, par exemple les flacons des tests JBL (17 ml).Remplir le flacon à ras bord.
- Ajouter 6 gouttes de R1 (0.3 ml) pour un échantillon de 17 ml. La quantité est approximative . Il faut simplement que le chlorure de manganèse soit en excès par rapport à la quantité d’oxygène maximale à révéler.
- Ajouter 6 gouttes de R2 (0.3 ml) pour un échantillon de 17 ml. La quantité est approximative. Il faut créer un milieu fortement basique pour provoquer l’oxydation du manganèse par l’oxygène présent dans l’échantillon.
- Fermer le flacon avec un bouchon de 15 mm s’insérant de 3 mm dans le col du flacon. Très important pour fermer le flacon sans aucune bulle d’air à l’intérieur. Veiller à enfoncer le bouchon toujours de façon identique pour obtenir un volume d’eau échantillonnée constant.
- Patienter 30 mn pour que tout l’oxygène réagisse avec le manganèse, tout en agitant régulièrement pour disperser le floculat.
- Mesurer au colorimètre 3 mn après préparation.
La quantité de produits achetée permet donc de réaliser plus de 3300 analyses sur des échantillons de 17 ml. Soit moins de 1 centime d’euro par analyse.
Construire un colorimètre
- Télécharger sur un smartphone android, l’applicatif Color Grab. (ou un produit équivalent sur iphone ou autres).
- Fabriquer une boite permettant d’accueillir le smartphone et le flacon à analyser. (25 €).
- Les conditions de mesure sont donc normalisées: éclairage constant avec la led du smartphone, distance smartphone-échantillon constante, positionnement de l’échantillon et du smartphone constants, point de mesure constant.
- Paramétrer Color Grab pour obtenir un affichage des mesures RVB (Rouge, Vert, Bleu)
Photos du prototype, dans la version « taisez-vous, je crée », après nombreux tâtonnements et ajustements…








Version définitive





Tester la qualité des mesures de l’oxygène dissous
Tester en premier la qualité de mesure du smartphone et la qualité de l’éclairage.
- Créer un échantillon témoin en insérant un papier de couleur orangée dans le flacon.
- réaliser une dizaine de mesures en additionnant R+V
- Calculer l’écart-type σ sur ces 10 mesures
- En déduire l’intervalle de confiance de l’analyseur du smarphone : valeur réelle comprise entre « mesure – σ « et » mesure + σ » avec 65% de probabilité ou valeur réelle comprise entre « mesure – 2σ « et » mesure + 2σ » avec 95% de probabilité . Pour le prototype réalisé σ= 1.5%, ayant un impact de +/-0.24 mg O2/l.

En second, tester la reproductibilité de la mesure en analysant 10 échantillons d’eau issus de la même source. Ce test cumule les erreurs d’analyse du colorimètre et celles liées à de la préparation de l’échantillon. La qualité de la mesure dépend particulièrement de l’absence de bulle d’air au moment de la fermeture du flacon.
- Analyser 10 échantillons issus du même bassin.
- Additionner les valeurs Rouge, Vert et calculer l’écart-type σ sur les 10 résultats obtenus
- Pour le prototype réalisé σ= 2.5%, soit +/-0.5 mg O2/l.
Établir la correspondance entre mesure de l’oxymètre et concentration en mg/l d’oxygène dissous
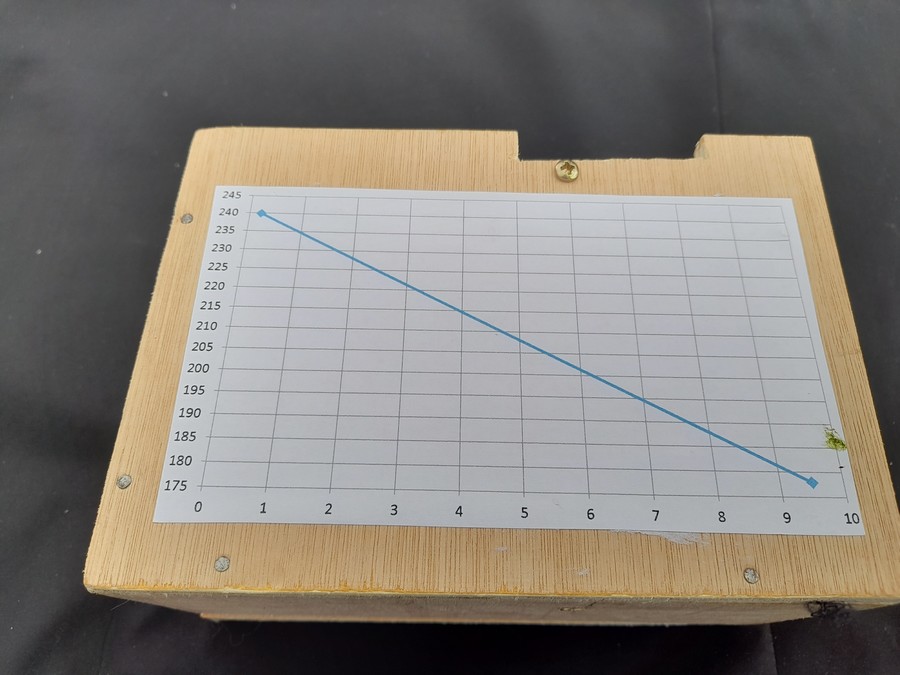
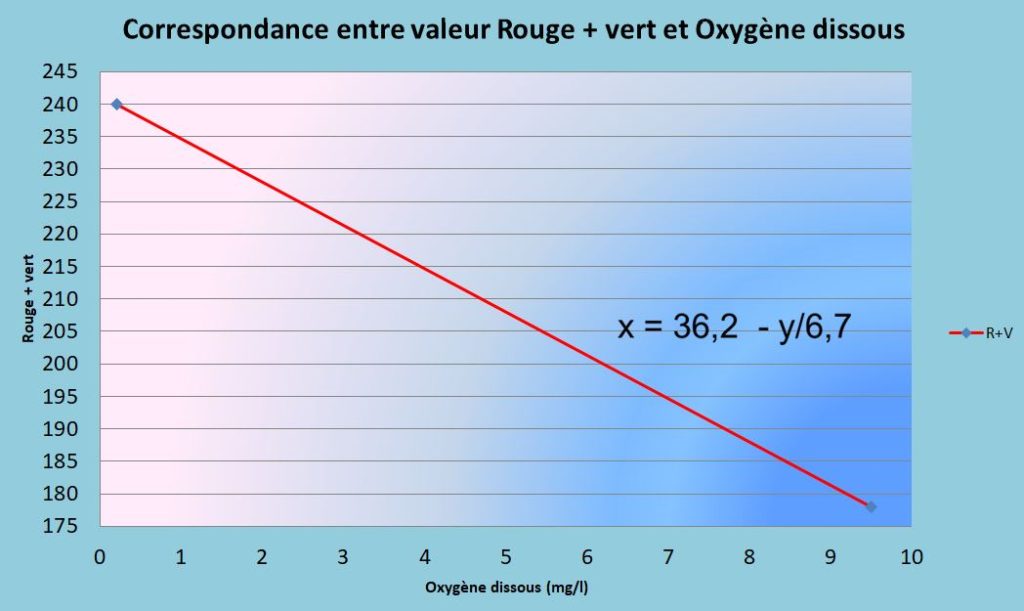
- Mettre de l’eau à bouillir avec un thermomètre pour suivre la température de l’eau. Prélever un échantillon d’eau à 100°. Analyser R+V = valeur pour 0 mg O2/l
- Prendre de l’eau à 15°. Mettre un bulleur pour saturer l’eau en oxygène pendant au moins 30 minutes, avec bulles fines et récipient profond (15 cm). Prélever un échantillon et obtenir la mesure R+V pour 10 mg O2/l.
- Il est possible d’obtenir des points intermédiaires sous réserve d’utiliser un bain marie pour maintenir la température à la même valeur pendant 30 minutes de bullage.
- Calculer la droite de régression sur les 2 valeurs R+V.
- Utiliser l’équation de la droite de régression ou le graphe, pour interpréter les mesures ultérieures. Coller le graphe sur le colorimètre pour une lecture direCte lors des mesures sur le terrain.
Cas concret : analyse de l’oxygène dissous dans différents compartiments de l’installation aquaponique « TA2400 ».
Quatre zones de prélèvement:
- Bassin de 1200 litres avec 45 truites de 500 g , eau à 17°C, bulleur 20 cm avec 1200 litres d’air injectés à 75 cm de profondeur. Mesure en sortie de bassin: 6.6 mg O2/l.
- Bassin de 1200 litres avec 15 ombles de 800 g , eau à 17°C, bulleur 20 cm avec 1200 litres d’air injectés à 75 cm de profondeur. Mesure en sortie de bassin: 8.4 mg O2/l.
- L’eau des deux bassins traverse les filtres gravitaires. Mesure en sortie de filtre: 7.4 mg O2/l.
- Puis l’eau traverse un biofiltre de 2.5 m3 de graviers (10 m2) planté en légumes. Mesure en sortie de biofiltre: 6.9 mg O2/l.
Ces mesures sont conformes à celles réalisées avec un oxymètre optique, quelques mois auparavant. Et en accord avec les valeurs attendues : Oxygène dissous plus important dans le bassin le moins chargé (10 kg/m3) par rapport au bassin plus chargé (19 kg/m3); consommation d’oxygène dans les filtres et biofiltre, avec la valeur la plus faible en sortie de biofiltre.


Excellent article qui demande de faire de la chimie , des mathématiques , de l’informatique , du bricolage low tech le tout pour un projet aquaécologique , excatement ce que l’on demande à nos jeunes en formation aquacole où les sciences sont mises en application pour un projet aquacole . Etant enseignant en lycée aquacole , ce projet de système de mesure colorimétrique devrait rapidement prendre forme pour en faire un exercice pratique , pluridisciplinaire pour nos jeunes étudiants de bac pro et bts pour le suivi de nos systèmes aquaponiques , d’aquariologie et d’aquaculture plus classiques . Merci beaucoup pour ce partage !
Merci pour le retour. Suite à l’exploitation de l’outil, j’ai dû apporter quelques modifications. Je vais mettre à jour l’article. Vous êtes de quel lycée?
Bonjour , je suis du legta du morvan !
https://www.morvanformations.com/legta/btsa-aquaculture-poisson/
Je viens de faire la mise à jour.
Vous êtes un inventeur « fou ». Chapeau pour votre maîtrise!
Merci.
Bonjour,
encore un chouette article fort bien documenté !
Tout est affaire de choix car soit on veut un système autonome qui revient cher à l’achat et à l’usage, soit on fait par soi même (DIY je crois) tout en comprenant ce que l’on réalise et que l’on pourra toujours maintenir sans grands frais.
Si j’ai bien compris :
– on fait des préparations de réactifs avec des
– on fabrique une boite pour la mesure.
Ainsi pour l’usage, chaque fois que l’on décide de faire la mesure : on prend un échantillon d’eau, on y dissout les réactifs, 30minutes plus tard on lit le résultat.
Tout cela pour moins de 1c€, ça me semble sympa.
Je fais de même régulièrement pour ma piscine hors-sol : « échantillon/réactif coloré/lecture/correction si nécessaire » pour le PH et le Cl, mais là il ne faut pas patienter 30 minutes ;o)
Merci pour ce partage et ces fines études Jean-Claude qui permettent à chacun de mieux appréhender l’aquaponie et de faire des choix personnels suivant ses moyens et ses convictions.
Paul
Merci Paul. En fait, on peut établir le référentiel en lisant la coloration au bout de deux minutes. Ce qui compte c’est de conserver la même méthode entre étalonnage et mesure des échantillons.
Ca a l air un peu complique
Je ne compernds comment il est possible comme cela de faire des mesrures en continu ce qu il est indispensable pour la reussite a l avenir de l aquaphonie a domicile
aujourdhui il existe des sondes optique .ca pourait etre plus serait interessant de creuser dans cette direction
Bonjour Raphael,
nous attendons avec impatience les résultats de vos recherches.
Cordialement.
Paul